El Vikipedio, la libera enciklopedio
Kalia fluoro-silikato
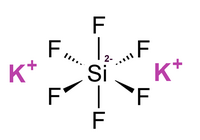
Plata kemia strukturo de la Kalia fluoro-silikato
Tridimensia kemia strukturo de la Kalia fluoro-silikato
Alternativa(j) nomo(j)
Heksa-fluoro-silikato de kalio
Hieratito
Kemia formulo K2 SiF6
CAS-numero-kodo 16871-90-2
ChemSpider kodo 55723
PubChem-kodo 61851
Fizikaj proprecoj
Aspekto blankaj kristaloj
Molmaso 220272 g·mol−1
Denseco 2,67g cm−3 [1]
Refrakta indico
n
761
20
{\displaystyle n_{761}^{20}}
1,3991
Solvebleco Akvo :1,2 g/L
Mortiga dozo (LD50) 125 mg/kg (buŝe)[2]
Sekurecaj Indikoj
Riskoj R23/24/25
Sekureco S26 S45
Pridanĝeraj indikoj
Danĝero
GHS Damaĝo Piktogramo
GHS Signalvorto Damaĝa substanco
GHS Deklaroj pri damaĝoj H301 , H311 , H331
GHS Deklaroj pri antaŭgardoj P261 , P264 , P270 , P271 , P280 , P301+310 , P302+352 , P304+340 , P311 , P312 , P321 , P330 , P361 , P363 , P403+233 , P405 , P501 [3]
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo25 °C kaj 100 kPa)
Kalia heksafluoro-silikato aŭ K2 [SiF6 ] estas neorganika kemia kombinaĵo de kalio , fluoro kaj silicio , senkolora aŭ blanka substanco kiam hidratigita. Ĝi uzatas kiel insekticido, raticido kaj en fabrikado de sinteza kriolito . Kiam varmigita al 800 °C (sub ĝia hidratigita formo) ĝi malkomponiĝas en la gasoj hidrogena fluorido kaj silicia kvarfluorido.
H
2
S
i
F
6
+
2
K
C
l
→
K
2
[
S
i
F
6
]
+
2
H
C
l
{\displaystyle \mathrm {H_{2}SiF_{6}+2\ KCl\rightarrow K_{2}[SiF_{6}]+2\ HCl} }
2
K
F
+
S
i
F
4
→
K
2
[
S
i
F
6
]
{\displaystyle {\mathsf {2\;KF+SiF_{4}\ {\xrightarrow {}}\ K_{2}[SiF_{6}]}}}
H
2
[
S
i
F
6
]
+
2
K
O
H
→
K
2
[
S
i
F
6
]
+
2
H
2
O
{\displaystyle {\mathsf {H_{2}[SiF_{6}]+2\;KOH\ {\xrightarrow {}}\ K_{2}[SiF_{6}]+2\;H_{2}O}}}
H
2
[
S
i
F
6
]
+
K
2
C
O
3
→
K
2
[
S
i
F
6
]
+
H
2
O
+
C
O
2
↑
{\displaystyle {\mathsf {H_{2}[SiF_{6}]+K_{2}CO_{3}\ {\xrightarrow {}}\ K_{2}[SiF_{6}]+H_{2}O+CO_{2}\uparrow }}}
Kiam hejtata, heksafluorosilikato de kalio disproporciiĝas:
K
2
[
S
i
F
6
]
→
570
−
600
o
C
2
K
F
+
S
i
F
4
{\displaystyle {\mathsf {K_{2}[SiF_{6}]\ {\xrightarrow {570-600^{o}C}}\ 2KF+SiF_{4}}}}
Per traktado kun forta acido, ĝi malkomponiĝas:
K
2
[
S
i
F
6
]
+
H
2
S
O
4
→
K
2
S
O
4
+
S
i
F
4
↑
+
2
H
F
↑
{\displaystyle {\mathsf {K_{2}[SiF_{6}]+H_{2}SO_{4}\ {\xrightarrow {}}\ K_{2}SO_{4}+SiF_{4}\uparrow +2HF\uparrow }}}
La samo okazas per agado de fortaj alkaloj:
K
2
[
S
i
F
6
]
+
8
K
O
H
→
K
4
S
i
O
4
+
6
K
F
+
4
H
2
O
{\displaystyle {\mathsf {K_{2}[SiF_{6}]+8\;KOH\ {\xrightarrow {}}\ K_{4}SiO_{4}+6\;KF+4\;H_{2}O}}}
K
2
[
S
i
F
6
]
+
2
K
2
C
O
3
→
100
o
C
6
K
F
+
S
i
O
2
+
2
C
O
2
↑
{\displaystyle {\mathsf {K_{2}[SiF_{6}]+2\;K_{2}CO_{3}\ {\xrightarrow {100^{o}C}}\ 6\;KF+SiO_{2}+2\;CO_{2}\uparrow }}}
Sub agado de fluorida acido ĝi estigas la gason silician kvarfluoridon:
K
2
[
S
i
F
6
]
+
2
H
F
→
100
o
C
2
K
(
H
F
2
)
+
S
i
F
4
↑
{\displaystyle {\mathsf {K_{2}[SiF_{6}]+2HF\ {\xrightarrow {100^{o}C}}\ 2\;K(HF_{2})+SiF_{4}\uparrow }}}
Kiam fandita kun aluminio ĝi estigas kalian heksafluoridon:
K
2
[
S
i
F
6
]
+
2
A
l
→
700
o
C
K
3
[
A
l
F
6
]
+
2
K
(
H
F
2
)
+
S
i
F
4
↑
{\displaystyle {\mathsf {K_{2}[SiF_{6}]+2Al\ {\xrightarrow {700^{o}C}}\ K_{3}[AlF_{6}]+2\;K(HF_{2})+SiF_{4}\uparrow }}}
Metodo de Kawecki: Miksaĵo de heksafluorosilikato de zirkonio estas rostita kun silikato de zirkonio por doni la akvosolveblan heksazirkoniaton de kalio[4]
K
2
[
S
i
F
6
]
+
Z
r
S
i
O
4
→
875
o
C
K
3
[
Z
r
F
6
]
+
2
S
i
O
2
↑
{\displaystyle {\mathsf {K_{2}[SiF_{6}]+ZrSiO_{4}\ {\xrightarrow {875^{o}C}}\ K_{3}[ZrF_{6}]+2\;SiO_{2}\uparrow }}}
En 1823, Berzelius izolis puran silicion reakciigante kalian heksafluorosilikaton kun kalio, laŭ la ekvacio:
K
2
[
S
i
F
6
]
+
4
K
→
875
o
C
6
K
F
+
S
i
↑
{\displaystyle {\mathsf {K_{2}[SiF_{6}]+4\,K\ {\xrightarrow {875^{o}C}}\ 6\,KF+Si\uparrow }}}
Neorganikaj saloj de kalio






![{\displaystyle \mathrm {H_{2}SiF_{6}+2\ KCl\rightarrow K_{2}[SiF_{6}]+2\ HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1824fa1e86e9186f23f24b962fcc410eddcd1e87)
![{\displaystyle {\mathsf {2\;KF+SiF_{4}\ {\xrightarrow {}}\ K_{2}[SiF_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58aba6fa81e9a7f15bf97a1cee5f469ef7faf167)
![{\displaystyle {\mathsf {H_{2}[SiF_{6}]+2\;KOH\ {\xrightarrow {}}\ K_{2}[SiF_{6}]+2\;H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d57e0041ff6dbb42e6615e5ab40fe7075ddb3886)
![{\displaystyle {\mathsf {H_{2}[SiF_{6}]+K_{2}CO_{3}\ {\xrightarrow {}}\ K_{2}[SiF_{6}]+H_{2}O+CO_{2}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d892fbab7a2f341402d089f534c7351fda31af36)
![{\displaystyle {\mathsf {K_{2}[SiF_{6}]\ {\xrightarrow {570-600^{o}C}}\ 2KF+SiF_{4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7efa56839cf314dcbca3d7a1f4f007800dfe1598)
![{\displaystyle {\mathsf {K_{2}[SiF_{6}]+H_{2}SO_{4}\ {\xrightarrow {}}\ K_{2}SO_{4}+SiF_{4}\uparrow +2HF\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc3119c44a95eafd00a5ce5187a1b3feb7de1b61)
![{\displaystyle {\mathsf {K_{2}[SiF_{6}]+8\;KOH\ {\xrightarrow {}}\ K_{4}SiO_{4}+6\;KF+4\;H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df2f462dea5ecbf68df57f7745d7cb862a633b50)
![{\displaystyle {\mathsf {K_{2}[SiF_{6}]+2\;K_{2}CO_{3}\ {\xrightarrow {100^{o}C}}\ 6\;KF+SiO_{2}+2\;CO_{2}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c2001f129502af991d02f7e7694414f31863e700)
![{\displaystyle {\mathsf {K_{2}[SiF_{6}]+2HF\ {\xrightarrow {100^{o}C}}\ 2\;K(HF_{2})+SiF_{4}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/40f8dfb2dbba34e97ec5325f53e212c13d172698)
![{\displaystyle {\mathsf {K_{2}[SiF_{6}]+2Al\ {\xrightarrow {700^{o}C}}\ K_{3}[AlF_{6}]+2\;K(HF_{2})+SiF_{4}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9219dd43f20a5ca677b4cfa2fdfb9e5b733a5e7e)
![{\displaystyle {\mathsf {K_{2}[SiF_{6}]+ZrSiO_{4}\ {\xrightarrow {875^{o}C}}\ K_{3}[ZrF_{6}]+2\;SiO_{2}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca633fbdf4b525a2557fd3e7f63f43d86fbe8078)
![{\displaystyle {\mathsf {K_{2}[SiF_{6}]+4\,K\ {\xrightarrow {875^{o}C}}\ 6\,KF+Si\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb66de185338a65522b22569081b9f768911aabd)
