El Vikipedio, la libera enciklopedio
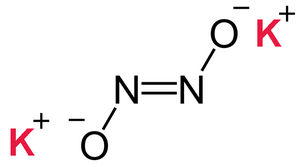
Kalia hipo-nitrito aŭ K2 N2 O2 estas neorganika komponaĵo, malstabila senkolora substanco, kies derivaĵo, la hiponitrita acido estas produktata per reakcio kun forta acido en etera medio. Kutime, la metalaj saloj de la hiponitrita acido estiĝas per reduktado de kalia/hidrarga amalgamo kaj kalia nitrato . Aliflanke, metala kalio povas diseriĝi en solvaĵo de piridino sub hidrogena atmosfero. La kalia-piridina adukto povas agi kiel reduktagento rilate al la nitrata oksido[1]
2
K
+
2
N
O
→
p
i
r
i
d
i
n
o
b
e
n
z
e
n
o
K
2
N
2
O
2
{\displaystyle {2\,K+2\,NO{\xrightarrow[{piridino}]{benzeno}}K_{2}N_{2}O_{2}}}
Hiponitritoj estas substancoj enhavantaj anjonon [ON=NO]2- kaj la acidaj hiponitriloj enhavas la anjonon [HON=NO]- .
2
K
N
O
3
+
8
K
/
H
g
+
4
H
2
O
→
40
o
C
K
2
N
2
O
2
+
8
K
O
H
+
H
g
{\displaystyle {\mathsf {2\;KNO_{3}+8\;K/Hg+4\;H_{2}O\ {\xrightarrow {40^{o}C}}\ K_{2}N_{2}O_{2}+8\;KOH+Hg}}}
Ĝi estiĝas per oksidigo de koncentrita hidroksilamino kaj Kalia nitrito en alkala medio:
N
H
2
O
H
+
K
N
O
2
+
K
O
H
→
K
2
N
2
O
2
+
2
H
2
O
{\displaystyle {\mathsf {NH_{2}OH+KNO_{2}+KOH\ {\xrightarrow {}}\ K_{2}N_{2}O_{2}+2\,H_{2}O}}}
H
2
N
2
O
2
+
2
K
O
H
→
K
2
N
2
O
2
+
2
H
2
O
{\displaystyle {\mathsf {H_{2}N_{2}O_{2}+2\,KOH\ {\xrightarrow {}}\ K_{2}N_{2}O_{2}+2\,H_{2}O}}}
2
K
N
O
2
+
4
K
(
H
g
)
+
2
H
2
O
→
K
2
N
2
O
2
+
4
K
O
H
{\displaystyle {\mathsf {2\,KNO_{2}+4\;K(Hg)+2\;H_{2}O\ {\xrightarrow {}}\ K_{2}N_{2}O_{2}+4\;KOH}}}
Sammaniere, amalgamoj de magnezio kaj hidrargo fandiĝas kun nitratoj por doni hiponitritojn en akva medio[1]
K
N
O
3
+
4
M
g
/
H
g
+
4
H
2
O
→
K
2
N
2
O
2
+
4
M
g
(
O
H
)
2
+
4
H
g
{\displaystyle {KNO_{3}+4\,Mg/Hg+4\,H_{2}O{\xrightarrow[{}]{}}K_{2}N_{2}O_{2}+4\,Mg(OH)_{2}+4\,Hg}}
Kalia hiponitrito komplete malkomponiĝas sub agado de la koncentrita sulfata acido . La reakcio estas eksploda kaj liberigas nitrozan oksidon[3]
K
2
N
2
O
2
+
H
2
S
O
4
→
K
2
S
O
4
+
H
2
O
+
N
2
O
n
i
t
r
o
z
a
o
k
s
i
d
o
↑
{\displaystyle {K_{2}N_{2}O_{2}+H_{2}SO_{4}{\xrightarrow[{}]{}}K_{2}SO_{4}+H_{2}O+{\underset {nitroza\,oksido}{N_{2}O}}\uparrow }}
K
2
N
2
O
2
+
2
H
C
l
→
100
o
C
2
K
C
l
+
N
2
O
↑
+
H
2
O
{\displaystyle {\mathsf {K_{2}N_{2}O_{2}+2\;HCl\ {\xrightarrow {100^{o}C}}\ 2\;KCl+N_{2}O\uparrow +H_{2}O}}}
Dum pasado de klorida acido tra glacia solvaĵo de kalia hiponitrito, hiponitrita acido estiĝas:
K
2
N
2
O
2
+
2
H
C
l
→
0
o
C
H
2
N
2
O
2
+
2
K
C
l
{\displaystyle {\mathsf {K_{2}N_{2}O_{2}+2\;HCl\ {\xrightarrow {0^{o}C}}\ H_{2}N_{2}O_{2}+2\;KCl}}}
K
2
N
2
O
2
+
4
H
(
Z
n
,
K
O
H
)
o
+
2
H
2
O
→
2
N
H
2
O
H
+
2
K
O
H
{\displaystyle {\mathsf {K_{2}N_{2}O_{2}+4\;H_{(Zn,KOH)}^{o}+2\;H_{2}O\ {\xrightarrow {}}\ 2\;NH_{2}OH+2\;KOH}}}
K
2
N
2
O
2
+
3
I
2
+
3
H
2
O
→
K
N
O
3
+
K
N
O
2
+
6
H
I
{\displaystyle {\mathsf {K_{2}N_{2}O_{2}+3\,I_{2}+3\,H_{2}O\ {\xrightarrow {}}\ KNO_{3}+KNO_{2}+6\,HI}}}
K
2
N
2
O
2
+
2
A
g
N
O
3
→
A
g
2
N
2
O
2
↓
+
2
K
N
O
3
{\displaystyle {\mathsf {K_{2}N_{2}O_{2}+2\;AgNO_{3}\ {\xrightarrow {}}\ Ag_{2}N_{2}O_{2}\downarrow +2\;KNO_{3}}}}
K
2
N
2
O
2
+
C
O
2
→
K
2
C
O
3
+
N
2
O
↑
{\displaystyle {\mathsf {K_{2}N_{2}O_{2}+CO_{2}\ {\xrightarrow {}}\ K_{2}CO_{3}+N_{2}O\uparrow }}}
Neorganikaj saloj de kalio






![{\displaystyle {2\,K+2\,NO{\xrightarrow[{piridino}]{benzeno}}K_{2}N_{2}O_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdc5d74e2ab493137d30d520106c6214f5a45fa6)




![{\displaystyle {KNO_{3}+4\,Mg/Hg+4\,H_{2}O{\xrightarrow[{}]{}}K_{2}N_{2}O_{2}+4\,Mg(OH)_{2}+4\,Hg}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e5431b3d0361f05fdeccbfccca88f29a94df1c53)
![{\displaystyle {K_{2}N_{2}O_{2}+H_{2}SO_{4}{\xrightarrow[{}]{}}K_{2}SO_{4}+H_{2}O+{\underset {nitroza\,oksido}{N_{2}O}}\uparrow }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d846bc3f52260853c687e57d37842bfa3b417f0)






