Natria hiponitrito
| Natria hiponitrito | ||||
| ||||
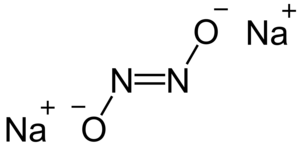
| Kemia strukturo de la Natria hiponitrito | ||||
| ||||
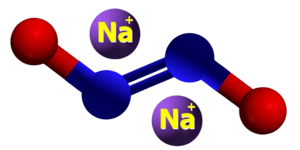
| Kemia strukturo de la Natria hiponitrito | ||||
| Alternativa(j) nomo(j) | ||||
| Hiponitrito de natrio | ||||
| Kemia formulo | ||||
| ChemSpider kodo | 8210166 | |||
| PubChem-kodo | 10034601 | |||
| Fizikaj proprecoj | ||||
| Aspekto | Senkoloraj kristaloj | |||
| Molmaso | 105.99 g mol−1 | |||
| Smiles | NaON=NONa | |||
| Denseco | 2.466 g/cm3 | |||
| Fandopunkto | 100 °C (212 ℉; 373 K) | |||
| Bolpunkto | 335 °C (635 ℉; 608 K) malkomponiĝas | |||
| Solvebleco | Akvo:solvebla | |||
| Nesolvebleco | Etanolo: nesolvebla | |||
| Sekurecaj Indikoj | ||||
| Risko | R9 R20 R21 R22 R44 | |||
| Sekureco | S14 S16 S27 S36 S37 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H300, H302, H315 | |||
| GHS Deklaroj pri antaŭgardoj | P101, P102, P103, P202, P270 | |||
(25 °C kaj 100 kPa) | ||||
Natria hiponitrito, hiponitrito de natrio aŭ Na2N2O2 estas neorganika komponaĵo, senkolora natria salo rezultanta el reakcio inter natria nitrato kaj amalgamo de Natrio/Hidrargo aŭ pere de hidroksilamina sulfonata acido kaj natria hidroksido. Kiel derivaĵo de la hiponitrita acido ĝi povas prezentiĝi sub la formoj trans kaj cis, kaj povas eksplodi kiam en seka kondiĉo. Kiel salo de malforta acido kaj forta bazo ĝi malkomponiĝas sub hejtado per liberigo de gaso nitroza oksido. Kvankam la cis-formo de la natria hiponitrito povas ekzisti, ĝi tuj malkomponiĝas per aldono de akvo[1].
Sintezo[redakti | redakti fonton]
- Natria hiponitrito prepareblas per reduktado de koncentrita varma solvaĵo de natria nitrato kaj natria-hidrarga amalgamo[2]:
- Ĝi estiĝas per oksidado de koncentrita hidroksilamino kaj natria nitrito en alkala medio:
- Neŭtraligo de hiponitrita acido kaj natria hidroksido:
- Pere de alkohola solvaĵo kun natria nitrito kaj amalgamo de natrio kaj hidrargo:
Reakcioj[redakti | redakti fonton]
- Kiam hejtata, natria hiponitrito malkomponiĝas:
- Ĝi estas atakata de koncentrita klorida acido:
- Dum pasado de klorida acido tra glacia solvaĵo de natria hiponitrito, hiponitrita acido estiĝas:
- Oksidado de jodo al jodida acido:
- Duobla interŝanĝa reakcio inter natria hiponitrito kaj nitrata arĝento:
- Ĝi reakcias kun karbona duoksido:
Literaturo[redakti | redakti fonton]
- Chemical Book
- ACS Publications
- A Text Book of Inorganic Chemistry, Anil Kumar De
- Modern Methods of Plant Analysis / Moderne Methoden der Pflanzenanalyse
- NOx Related Chemistry
- A Text Book of Inorganic Chemistry, Anil Kumar De
- Chemistry of the Elements, N. N. Greenwood,A. Earnshaw
- The Chemistry of Nitrogen: Pergamon Texts in Inorganic Chemistry, K. Jones
| ||||||
Referencoj[redakti | redakti fonton]
- ↑ Advances in Inorganic Chemistry and Radiochemistry, Volume 22
- ↑ The Chemistry of Lithium, Sodium, Potassium, Rubidium, Cesium and Francium ..., William A. Hart,O. F. Beumel,Thomas P. Whaley
- ↑ Ĝenerale atomaj hidrogenoj estiĝas per reakcio inter forta acido kaj metalo kiu dislokigas hidrogenon el la acido.
















