| Natria selenato
|
|
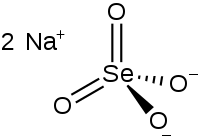
Kemia strukturo de la
Natria selenato
|
| Dosiero:Sodium selenate3D.png
|
3D Kemia strukturo de la
Natria selenato
|
| Kemia formulo |
Na2SeO4
|
| CAS-numero-kodo |
13410-01-0
|
| ChemSpider kodo |
24185
|
| PubChem-kodo |
25960
|
| Fizikaj proprecoj
|
| Aspekto |
Blanka aŭ grizkolora pulvoro
|
| Molmaso |
- 188.95 g mol−1
- 331,0434 g mol−1 (heptahidrata)
- 369,09 g mol−1 (dekahidrata)
|
| Smiles |
[O-][Se](=O)(=O)[O-].[Na+].[Na+]
|
| Denseco |
3,098 g/cm3
|
| Solvebleco |
Akvo:Solvebla
|
| Mortiga dozo (LD50) |
18,45 mg/kg (muso, buŝa) (Nofre)
|
| Merck Index |
|
| Sekurecaj Indikoj
|
| Risko |
R23/25 R33 R50/53
|
| Sekureco |
S(S1/2) S20/21 S28 S45 S60 S61
|
| Pridanĝeraj indikoj
|
| Danĝero
|
| GHS etikedigo de kemiaĵoj
|
| GHS Damaĝo-piktogramo |
|
| GHS Signalvorto |
Damaĝa substanco
|
| GHS Deklaroj pri damaĝoj |
H331, H301, H373, H400, H410
|
| GHS Deklaroj pri antaŭgardoj |
P260, P261, P264, P271, P273, P301+310, P304+340, P311, P314, P330, P391, P403+233, P405, P501
|
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo
(25 °C kaj 100 kPa)
|
Natria selenato, selenato de natrio aŭ Na2SeO4 estas neorganika oksokombinaĵo de seleno kaj natrio, troveblas en la formoj anhidra, heptahidrata kaj dekahidrata, blanka substanco tre solvebla en akvo. La dekahidrata formulaĵo estas ordinara ingredienco en multevitaminaĵoj kaj bovara nutrado kiel selenofonto.
La anhidra salo uzatas en la produktado de vitraĵoj. Kvankam la selenatoj estas multe pli toksaj, multaj fizikaj proprecoj de natria selenato kaj natria sulfato iel similas. Natria selenato estas ankaŭ ingredienco de kelkaj fungicidoj, pesticidoj kaj insekticidoj.
Seleno estas nature okazanta substanco tre toksa en altaj koncentriĝoj, tamen ĝi same estas esenca elemento kiel dieta suplemento. Selenida acido estas la plej toksa selena kombinaĵo[1]. Mallongedaŭra ekspozicio al la elementa seleno, selenida acido kaj selena duoksido per inhalado rezultas ĉefe en spirefektoj, tiel kiel irito de la mukoza membrano, pulmedemo, kronika bronkito kaj bronkita pneŭmonito.
Epidemiologiaj esploroj pri homoj kronike (longedaŭre) ekspoziciitaj al altaj niveloj de seleno en manĝaĵo kaj akvo, raportas senkoloriĝon de haŭto, patologia misformado kaj ungoperdoj, hararfalado, tro da dento- perdo kaj senkolorigo, manko de mensatento, kaj apatio.
Epidemiologiaj studoj daŭre elmontras inversan asociiĝon inter seleno-niveloj en la sango kaj kancerokazo, kaj studoj pri bestoj daŭre elmontras ke selenaj suplementoj, tiel kiel natria selenato, natria selenido kaj aliaj organikaj formoj de seleno, rezultas en reduktita incido je pluraj tumoro-tipoj.
La sola selena komponaĵo kiu elmontriĝas kancerogena al bestoj estas selena sulfido, kiu rezultis en pligrandigo de hepato-tumoroj ekde buŝa ekspozicio. La Usona Agentejo por Vivmedia protektado (EPA) klasas elementan selenon kiel apartenanta al la Grupo D, ne konsiderata kancerogena al homoj, kaj selena sulfido al la Grupo B2, probable homa kancerogena.[2]

|

|

|

|
- Oksidigo de natria selenito:

|
- Elektrolizo de solvaĵo da natria selenito:

|

|

|
- Kiam hejtata, natria selenato malkomponiĝas:

|
- La kristala salo estiĝas per hejtado kaj vakua sekigo:

|
- Per selenata acido ĝi estigas acidan salon de la respektiva acido:

|

|
- Per hidrogeno ĝi reduktiĝas al natria selenido:

|
- Ĝi partoprenas en reakcio pri duobla interŝanĝo kun baria klorido:

|
- Ĝi reakcias kun sulfura trioksido:

|






















