Natria bromato
Aspekto
| Natria bromato | ||||

| ||||
| Kemia strukturo de la Natria bromato | ||||
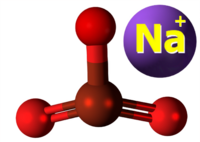
| ||||
| 3D Kemia strukturo de la Natria bromato | ||||

| ||||
| Blankaj kristaloj de natria bromato | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 7789-38-0 | |||
| ChemSpider kodo | 23009 | |||
| PubChem-kodo | 23668195 | |||
| Fizikaj proprecoj | ||||
| Aspekto | Senkolora aŭ blankaj kristaloj, senodoraj | |||
| Molmaso | 150,892 g mol−1 | |||
| Denseco | 3,339 g/cm3 | |||
| Refrakta indico | 1,594 1,6168 | |||
| Fandopunkto | 381 °C (718 ℉; 654 K) | |||
| Bolpunkto | 1,390 °C (2,530 ℉; 1,660 K) | |||
| Solvebleco:Akvo | ||||
| Nesolvebleco | ||||
| Mortiga dozo (LD50) | 140 mg/kg (muso, buŝa) | |||
| Ekflama temperaturo | 281 °C (554 K) °C | |||
| Sekurecaj Indikoj | ||||
| Risko | R8 R9 R22 R36 R37 R38 | |||
| Sekureco | S17 S22 S26 S27 S36 S37 S39 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj[1] | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H272, H302, H315, H319, H335 | |||
| GHS Deklaroj pri antaŭgardoj | P210, P261, P305+351+338, P310 | |||
(25 °C kaj 100 kPa) | ||||
Natria bromato, bromato de natrio aŭ NaBrO3 estas neorganika kombinaĵo, blanka salo de bromata acido kaj forta oksidanto. Natria bromato uzatas ĉefe en tinkturaj procezoj kontinuaj aŭ pluretapaj envolvantaj sulfuron aŭ pigmentajn kuvojn kaj kiel permanenta harararanĝo, kemia agento, aŭ ora solvanto kiam uzata kun natria bromido.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Natria bromato estiĝas pere de reakcio inter broma solvaĵo sur varma kaj koncentrita natria hidroksido:
Sintezo 2
[redakti | redakti fonton]- Produktado per reakcio inter broma solvaĵo kaj natria karbonato:
Sintezo 3
[redakti | redakti fonton]- Natria bromato estiĝas pere de elektrolizo de solvaĵo de natria bromido:
Sintezo 4
[redakti | redakti fonton]- Oksidado de bromo kaj kloro en la ĉeesto de natria hidroksido:
Sintezo 5
[redakti | redakti fonton]- Malkomponado per natria perbromato:
Sintezo 6
[redakti | redakti fonton]- Bromoksidigo per natria klorato en nitrata acido varme diluita:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Malkomponado per hejtado:
2  2 2 |
Reakcio 2
[redakti | redakti fonton]- Natria bromata estas forta oksidagento:
Reakcio 3
[redakti | redakti fonton]- Natria bromata estas reduktita al natria bromido pere de amoniako:
Referencoj
[redakti | redakti fonton]- ↑ Brekland Scientific[rompita ligilo]
Literaturo
[redakti | redakti fonton]- Alkali Metal Halates, Ammonium Iodate & Iodic Acid: Solubility Data Series[rompita ligilo], H. Miyamoto, M. Salomon
- Crystals and Crystal Growing, Alan Holden, Phylis Morrison
- A Comprehensive Guide to the Hazardous Properties of Chemical Substances, Pradyot Patnaik
- Hairdressing Including Barbering Units: S/NVQ Level 2, Leah Palmer
- Hair and Hair Care, Dale H. Johnson
- Chemical Book
- Santa Cruz Biotechnology
- Centroj por Kontrolo kaj Preventado de Malsanoj
- United States Department of Labor Arkivigite je 2016-03-05 per la retarkivo Wayback Machine
- Cameo Chemicals
- Concise Encyclopedia Chemistry, Mary Eagleson
- Oxford Desk Reference: Toxicology, Nick Bateman, Robert Jefferson, Simon Thomas, John Thompson, Allister Vale
- Handbook on Cosmetics (Processes, Formulae with Testing Methods), S.K. Singh
Eksteraj ligiloj
[redakti | redakti fonton]- Synthesis of sodium bromated and potassium metaperiodate
- NaBrO3/Mg - Explosionsandfire
- Bromate - Iodide Clock Reaction Lab
| ||||||








![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{80^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bb9792d1d0896d65ab8bfeac5156963c136fc68)



![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{e^{-}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f249d6782617909aea87ec0918a930b2ba093e44)

![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{275^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9bca68f458e90fac1e5e7a20d56140fef0ddd609)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{384^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68fe76db1214d0c25770fee19bbf4c3ceeb52362)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{450^{o}C\;-\;550^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b566f840cd625925e03fb0994dd2ed4ea2f0dbb7)

![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{340^{o}C\;-\;400^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/710c9aa6f551d19da94f0192feb79394e571f515)

