Natria sulfido
| Natria sulfido | |||||

| |||||
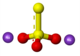
| Bastona kemia strukturo de la natria sulfido | |||||

| |||||
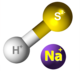
| Kemia strukturo de la natria sulfido | |||||

| |||||
| Kristala strukturo de la natria sulfido | |||||

| |||||
| Flavecaj kristaloj de natria sulfido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | |||||
| ChemSpider kodo | 14120 | ||||
| PubChem-kodo | 237873 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | Senkolora, flaveca aŭ ruĝeca higroskopa solido kun odoro je putraj ovoj | ||||
| Molmaso |
| ||||
| Denseco |
| ||||
| Fandopunkto | |||||
| Solvebleco:Akvo | |||||
| Sekurecaj Indikoj | |||||
| Risko | R22 R24 R31 R34 R50 | ||||
| Sekureco | S(S1/2) S26 S36/37/39 S45 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj[1][2] | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝo | ||||
| GHS Deklaroj pri damaĝoj | H251, H290, H301, H311, H314, H315, H318, H400 | ||||
| GHS Deklaroj pri antaŭgardoj | P264, P273, P280, P301, P302+352, P303, P304, P305, P305+351+338, P310, P330, P332+313, P338, P340, P351, P353, P361, P362, P391, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Natria sulfido, sulfido de natrio aŭ Na2S estas kemia komponaĵo ordinare trovebla sub la formo naŭhidratohava aŭ Na2S . 9 H2O. Ambaŭ estas senkoloraj kiam puraj, akvosolveblaj donante fortajn alkalajn solvaĵojn. Kiam ekspoziciita en humida aero, natria sulfido kaj ĝiaj hidratoj estigas sulfidan acidon, kiu posedas odoron je putrantaj ovoj. La komerca produkto elmontras ioman flavecan koloron pro la ĉeesto de polisulfidoj. Ĉi-specimenoj de natria sulfido estas komercigitaj sub la formo de flokoj. Kvankam la solido estas flava, solvaĵoj de natria sulfido estas senkoloraj.
Sintezo[redakti | redakti fonton]
Sintezo 1[redakti | redakti fonton]
- Kiam hejtata, natria bisulfido malkomponiĝas por estigi natrian sulfidon:
- Preparado de natria sulfido per sensulfurigo de natria bisulfido'
Sintezo 2[redakti | redakti fonton]
- Per reduktiĝo de natria sulfato kaj hidrogeno:
Sintezo 3[redakti | redakti fonton]
- Per reduktiĝo de natria sulfato kaj karbono:
Sintezo 4[redakti | redakti fonton]
- Per reduktiĝo de natria sulfato kaj karbona monooksido:
Sintezo 5[redakti | redakti fonton]
- Neŭtraliga reakcio inter natria hidroksido kaj natria bisulfido:
Sintezo 6[redakti | redakti fonton]
- Neŭtraliga reakcio inter natria hidroksido kaj sulfida acido
Sintezo 7[redakti | redakti fonton]
- Sub altaj temperaturoj natria sulfito suferas malkomponiĝon por estigi natrian sulfaton kaj natrian sulfidon[3]:
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Natria sulfido reakcias kun acidoj:
Reakcio 2[redakti | redakti fonton]
- Fortaj acidoj atakas natrian sulfidon:
Reakcio 3[redakti | redakti fonton]
- Natria sulfido estas oksidata pere de kalia permanganato:
Reakcio 4[redakti | redakti fonton]
- Per hejtado kun jodo natria sulfido estas reduktata:
Reakcio 5[redakti | redakti fonton]
- Natria sulfido oksidiĝas per ago de natria hipoklorito[4]:
Reakcio 6[redakti | redakti fonton]
- Kiam ekspoziciita en aero, natria sulfido facile konvertiĝas al natria tiosulfato[5]:
Uzoj[redakti | redakti fonton]
Natria sulfido estas ĉefe uzata en pulpo kaj papera industrio pere de la Procezo Krafft[6].
Ĝi uzatas en akvotraktado kiel oksigenforiga agento kaj ankaŭ kiel metalprecipitanto, en fotografio per kemia procezo, en tekstila industrio kiel blankigilo, malsulfuriganto, malklorigagento kaj en ledo-tanado. Ĝi ankaŭ uzatas en kemia manufakturado kiel sulfonatiga kaj sulfometiliga agento. Ĝi uzatas en kaŭĉuko-fabrikado, tinkturoj surbaze de sulfuro kaj aliaj kemiaj komponaĵoj. En mineralogio, ĝi uzatas kiel flosagento, oleo-rekuperado, inko-fabrikado kaj farado de likva sapo. Ĝi trovas bonan aplikon ankaŭ kiel senhariga agento en ledo-procezado.
Literaturo[redakti | redakti fonton]
- Sigma Aldrich
- Chemical Book
- ChemicalLand21 Arkivigite je 2015-09-23 per la retarkivo Wayback Machine
- Santa Cruz Biotechnology
- Sodium, Anne O'Daly
- Handbook of Flotation Reagents: Chemistry, Theory and Practice: Volume 1 ...[rompita ligilo], Srdjan M. Bulatovic
- Concise Encyclopedia Chemistry, Mary Eagleson
- A Laboratory History of Chemical Warfare Agents, Jared Ledgard
- Industrial Inorganic Chemistry, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner
Referencoj[redakti | redakti fonton]
- ↑ Sigma Aldrich
- ↑ LabChem
- ↑ Chemistry, John Daintith
- ↑ Hazardous Laboratory Chemicals Disposal Guide, Third Edition, Margaret-Ann Armour
- ↑ Inorganic Chemistry, Egon Wiberg, Nils Wiberg
- ↑ Industrial Minerals and Their Uses: A Handbook and Formulary, Peter A. Ciullo
| ||||||
| ||||||









![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)


![{\displaystyle {\mathsf {{\xrightarrow[{-\;4\;ZnCl_{2}}]{4\;Zn\;+\;8\;HCl}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8743f919ac43806a7f142fb19ef1dde93a1b3d87)



![{\displaystyle {\mathsf {{\xrightarrow[{}]{varmo}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39f1c6c7ab29f583de5842596076f1dac2b5b61a)





![{\displaystyle {\mathsf {{\xrightarrow[{KMnO_{4}}]{4\;[O]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/56287a2d51d52158f2bbc64bd37eeb949d4436d7)