Natria tartrato
| Natria tartrato | ||
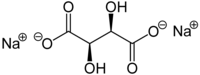
| ||
| Kemia strukturo de la Natria tartrato | ||

| ||
| 3D Kemia strukturo de la Natria tartrato | ||
| Kemia formulo | ||
| CAS-numero-kodo | ||
| ChemSpider kodo | 12786 | |
| PubChem-kodo | ||
| Fizikaj proprecoj | ||
| Aspekto | blankaj kristaloj | |
| Molmaso |
| |
| Smiles
| ||
| Denseco |
| |
| Fandopunkto | 150 °C | |
| Solvebleco | Akvo:29 g/100 ml (6 °C) | |
| Nutro-aldonaĵo | E335 | |
| Merck Index |
| |
| Sekurecaj Indikoj | ||
| Risko | R36/37/38 [1] | |
| Sekureco | S24/25 S36 S26 [1] | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H302 | |
| GHS Deklaroj pri antaŭgardoj | P264, P270, P301+312, P330, P501 | |
(25 °C kaj 100 kPa) | ||
Natria tartrato, tartrato de natrio aŭ C4H4Na2O6 estas natura organika kemiaĵo, senkolora aŭ blanka salo, uzata kiel emulsianto, oksidiganto kaj kontrolanto de acideco. En analiza kemio, ĝi ofte uzatas en la Titrado de Karl Fischer por determinigo de akvokvanto en kemiaj produktoj.
Sintezo
[redakti | redakti fonton]- Ĝi preparatas per reakcio de neŭtraligo de tartrata acido kaj natria karbonato:
- Aŭ per reakcio de neŭtraligo de tartrata acido kaj natria hidroksido:
Proprecoj
[redakti | redakti fonton]Ĝi aspektas kiel kristala pulvoro, tre solvebla en akvo kun iomete acida gusto. Ĝi disponeblas sub du strukturoj pri akvokristaliĝo: anhidra kaj duhidrata. Ĝia kapableco reteni akvomolekulojn igas ĝin ideala kiel ingredienco en la titrado de Fischer[2].
Uzoj
[redakti | redakti fonton]Ĝi ĉefe uzatas en la nutro-industrio kiel potencigilo de la anti-oksidigaj kapabloj de aliaj agentoj kaj en la konservado de marmeladoj (ĝia gusto iomete acida permesas reliefigi la gustojn de la fruktoj), margarinoj kaj en la preparado kaj procezado de fumaĵoj kiel kolbasoj. Kelkfoje ĝi uzatas kiel ingredienco en bufraj solvaĵoj[3] kombinitaj kun dunatria tartrato kaj ununatria tartrato.
Literaturo
[redakti | redakti fonton]- Sigma Aldrich
- ACS Publications
- Chemical Book
- Experimental Chemotherapy, R. J. Schnitzer, Frank Hawking
- Remington: The Science and Practice of Pharmacy, David B. Troy, Paul Beringer
| ||||||
Referencoj
[redakti | redakti fonton]- ↑ 1,0 1,1 1,2 Chemical Book
- ↑ Karl Fischer (1901-1958) estis germana kemiisto.
- ↑ Substancoj aŭ solvaĵoj, kiuj havas la econ igi la pH-on konstanta malgraŭ aldono de pli acidaj aŭ pli alkalaj substancoj.





