Kalia bismutato
| Kalia bismutato | |||
 | |||
| Plata kemia strukturo de la Kalia bismutato | |||
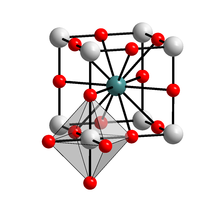 | |||
| Kristala strukturo de la Kalia bismutato | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 12589-75-2 | ||
| ChemSpider kodo | 175425 | ||
| PubChem-kodo | 202589 | ||
| Fizikaj proprecoj | |||
| Aspekto | ruĝa substanco | ||
| Molmaso | 296.076 g·mol−1 | ||
| Solvebleco | Akvo:Nesolvebla | ||
| Mortiga dozo (LD50) | 420 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R22 R36/37/38 | ||
| Sekureco | S26 S36 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H302, H315, H319, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P261, P305+351+338, P302+352, P321, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Kalia bismutato estas neorganika kemiaĵo de kalio kaj bismuto, ruĝa solidaĵo, kiu estas forta oksidiganto kaj nesolvebla en varma akvo. Ĝi estas unu el la malmultaj kaliaj saloj kiuj estas nesolveblaj en akvo. Tamen, ĝi komerce disponeblas kaj ĝiaj specimenoj povas esti miksaĵo da bismuta (IV) oksido, kalia karbonato kaj kalia peroksido. Kalia bismutato estis unue studata de Martin Jansen.
Bismutaj kombinaĵoj estas uzataj en kosmetikaĵoj, pigmentoj, tinkturoj kaj farmaciaĵoj. Kelkaj bismutaj derivaĵoj estas uzataj en la traktado de la diareo.
Sintezoj[redakti | redakti fonton]
Oksidado de bismuta oksido en alkala medio:
Sintezo 1[redakti | redakti fonton]
- Pere de kalia peroksido:
|
|
Sintezo 2[redakti | redakti fonton]
- Kune kun kalia hidroksido kaj kalia peroksido:
|
|
Sintezo 3[redakti | redakti fonton]
- Reakciante bismutan nitraton kaj kalia peroksido en ĉeesto de kalia hidroksido sub altega temperaturo:
|
|- |
Sintezo 4[redakti | redakti fonton]
- Bismutato de kalio same estiĝas per oksidigo de "bismuta hidroksido" kaj kalia hipoklorito en baza medio:
|
|
Sintezo 5[redakti | redakti fonton]
- kalia bismutato estiĝas ankaŭ pere de reakcio inter bismuta (III) oksido, kalia hidroksido kaj bromo:
|
|
Reakcioj[redakti | redakti fonton]
Reakcio 1[redakti | redakti fonton]
- Determinado de mangano en ŝtalo per bismutata metodo:
Manganaj saloj oksidiĝas al permanganatoj per troo da kalia bismutato en la ĉeesto de nitrata acido[1]:
|
|
Reakcio 2[redakti | redakti fonton]
- kalia bismutato reakcias kun koncentritaj acidoj:
|
|
Reakcio 3[redakti | redakti fonton]
- Samkiel nitrata acido:
|
|
Reakcio 4[redakti | redakti fonton]
- Kun hejtata nitrata acido:
|
|
Reakcio 5[redakti | redakti fonton]
- Ĝi malrapide reakcias kun alkaloj por estigi ortobismutaton:
|
|
Reakcio 6[redakti | redakti fonton]
- Varma akvo malkomponigas kalian bismutaton al kalia hidroksido, trioksido de bismuto kaj oksigeno:
|
|
Reakcio 7[redakti | redakti fonton]
- Oranĝo-ruĝa kombinaĵo (BiO2) estiĝas kiam kalia bismutato reakcias kun perklorata acido:[2]
|
|
Literaturo[redakti | redakti fonton]
- Chemical Book
- Science Direct
- Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens
- Inorganic Chemistry
- Text Book Of Inorganic Chemistry
Referencoj[redakti | redakti fonton]
| ||||||











![{\displaystyle {\mathsf {KBiO_{3}+6\;HCl\ {\xrightarrow {0^{o}C}}\ K[BiCl_{4}]+Cl_{2}\uparrow +3H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5947d98a49a13032441df593c40653702c8ffde7)





